Зачем выпускнику знать, как работают ферменты

Ферменты в действии — фокус, без которого высокий балл получить сложно. Темы белкового катализа встречаются в тестовой и развернутой частях. Экзаменаторы любят задачи, где нужно объяснить, почему реакция идёт быстрее, а энергия активации падает. Ученику, который понимает принцип, не требуется зубрёжка. Он видит связь структуры и функции прямо во время решения. Кроме того, знание ферментов полезно на межпредметных олимпиадах и в медвузе. Чем раньше выпускник освоит базу, тем меньше паники весной. Важно начать с простого: субстрат, активный центр, конформации. Далее добавляйте примеры — амилаза слюны, пепсин желудка, АТФ-синтаза митохондрий. Рассматривайте реальные опыты: изменение pH, нагревание, действие тяжёлых металлов. На кратких экспериментах теория становится живой. Тогда даже самый скучный параграф оживает и запоминается надолго.
Ферменты в действии: ключевые термины без лишних перегрузок
Чтобы не потеряться в терминологии, держите мини-словарь. Катализатор — вещество, ускоряющее реакцию, оставаясь неизменным. Белковая природа — большинство ферментов состоят из аминокислот, исключение — рибозимы. Субстрат — молекула, преобразуемая в продукт. Активный центр — участок, куда садится субстрат. Коэнзим — небелковый партнёр, часто витаминного происхождения. Холофермент — комплекс белка и кофактора. Апоэнзим — фермент без помощника, обычно неактивен. Кофактор — может быть ионом металла либо органической группой. Ингибитор — соединение, уменьшающее скорость реакции. Активация — обратный процесс, когда скорость растёт. Изучите модели «ключ-замок» и «индуцированное соответствие». Первая объясняет специфичность, вторая — гибкость белка. В вопросах ЕГЭ эти схемы появляются регулярно. Если запомните десять базовых определений, уже закроете половину возможных подвохов.
Четыре уровня структуры белка и роль активного центра
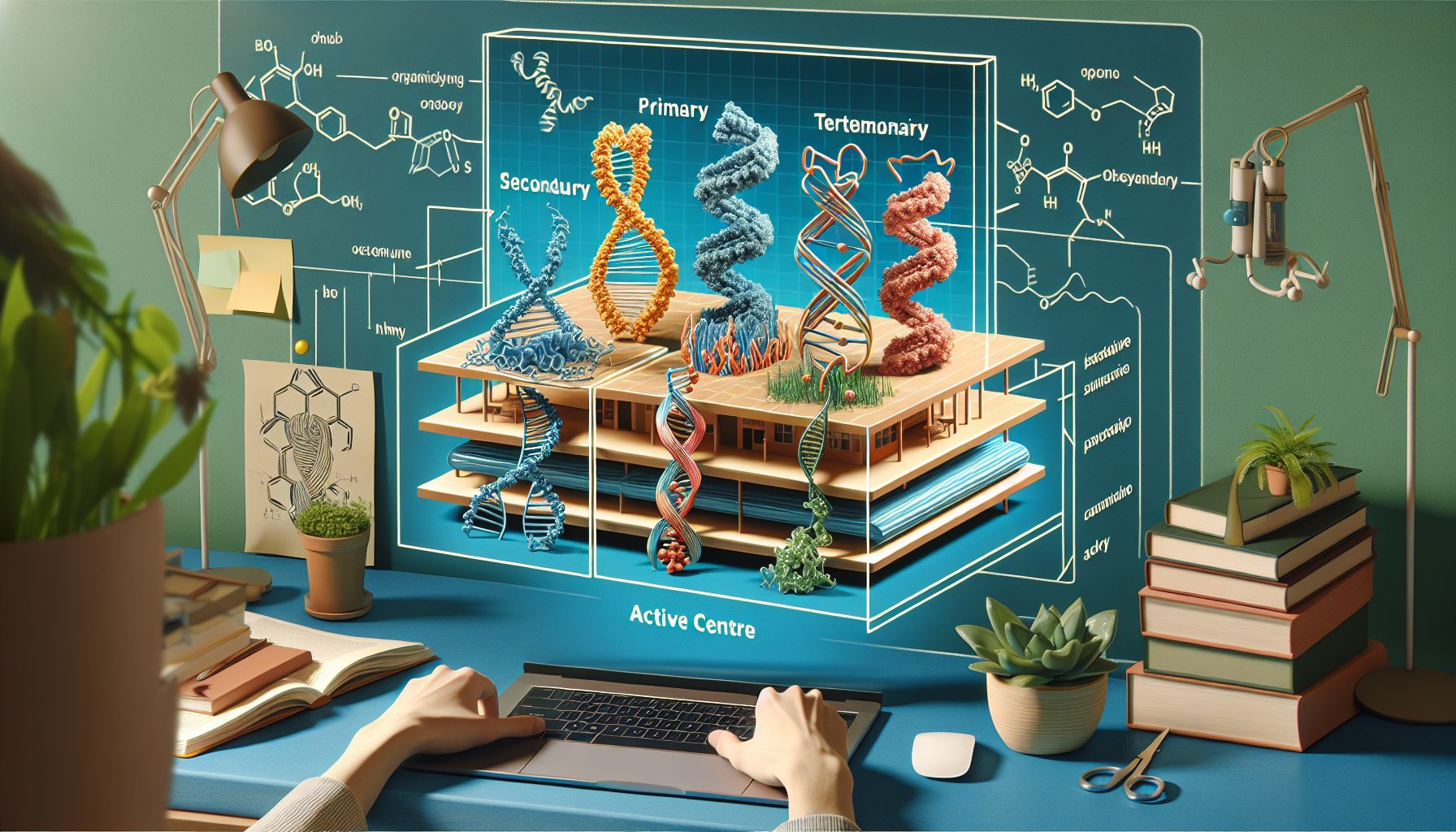
Начните с первичной структуры: цепочка аминокислот, соединённых пептидными связями. Далее следует вторичная — альфа-спирали и бета-складки, стабилизированные водородными контактами. Третичная строит глобулу с гидрофобным ядром и поверхностными радикалами. Наконец, четвертичная собирает несколько субъединиц в единую фабрику. Активный центр формируется на стадии третичной, иногда при участии четвертичной. Именно здесь расположены каталитические аминокислоты. Их боковые группы отдают ионы водорода, образуют переходные комплексы или временные ковалентные связи. Один, казалось бы, точечный дефект может обрушить всю активность. Поэтому мутации, меняющие даже одну аминокислоту, нередко вызывают болезни. Так, при серповидноклеточной анемии глутаминовая кислота заменена валином, и гемоглобин полимеризуется. Пример показывает, как важно понимать расположение радикалов в пространстве.
Температура, pH и другие факторы, влияющие на активность
Каждый фермент любит собственный «комфортный диван» из условий. Температура растёт — скорость удваивается по правилу Вант-Гоффа, пока не наступит денатурация. Обычно оптимум для человеческих белков около 37 °C, но у бактерий-термофилов цифра может превышать 70 °C. Изменение pH смещает заряд радикалов, поэтому пепсин работает в кислой среде, а трипсин — в слабощелочной. Концентрация субстрата ведёт к насыщению, которое описывает уравнение Михаэлиса-Ментен. После достижения скорости Vmax добавление субстрата уже бессильно. Ионы тяжёлых металлов или цианиды действуют как необратимые ингибиторы, связывая SH-группы. С другой стороны, лёгкие металлы, например Mg²⁺, активируют ДНК-полимеразу. Давление, ионная сила, наличие детергентов также влияют, но в школьных заданиях встречаются редко. Всё это можно потренировать на лабораторных графиках «скорость-температура» и «скорость-pH».
Кооперация и аллостерия: регуляция без лишних затрат энергии

Не все ферменты подчиняются классической гиперболической кривой. Гемоглобин, хотя и транспортный белок, демонстрирует кооперативное связывание кислорода, образуя сигмоидную зависимость. Подобный механизм характерен и для ферментов с несколькими субъединицами. Аллостерический эффект возникает, когда молекула-регулятор садится в отдельный центр, меняя конформацию всего комплекса. Активаторы стабилизируют R-форму, ингибиторы — T-форму. Такой способ экономит АТФ, ведь клетка не синтезирует новые белки, а лишь переключает уже существующие. Пример из метаболизма: фосфофруктокиназу-1 подавляет АТФ при высоком энергетическом статусе и активирует АМФ, сигнализирующий о голоде. На ЕГЭ могут спросить, почему аллостерия выгоднее классической конкурентной регуляции. Ответ прост: реакция происходит быстрее, так как не требует вытеснения субстрата из активного центра.
Чем биокатализ отличается от химического наглядно и без скуки
Школьники часто путают ферментативный и неорганический катализа. Главное отличие — специфичность. Катализатор платиновой группы ускорит десятки реакций, а фермент распознаёт только подходящий субстрат. Второй аспект — мягкость условий. Биокатализ идёт при физиологической температуре, нормальном давлении и в водной фазе. У неорганического собрата обычно нужны сотни градусов и агрессивные среды. Третий критерий — регулируемость. Фермент за доли секунды выключается ингибитором. Металлический катализатор остановить сложнее. Наконец, фермент способен к самовосстановлению благодаря биосинтезу в рибосомах. Химический катализатор после отравления требует дорогостоящей регенерации. Запомнив эти четыре пункта, вы легко отличите примеры в любой задаче.
Типовые задания ЕГЭ и проверенные стратегии решения

В тестовой части встречаются вопросы на определение: «Какой фактор снизит скорость действия пепсина?». Ответ ищите, вспоминая оптимальный pH. В задании с выбором трёх верных утверждений проверяется знание терминов. Полностью решите демоверсию, затем откройте банк ФИПИ, вырежьте все вопросы про ферменты и сделайте мини-тест. Во второй части часто просят объяснить влияние температуры по графику. Стройте логичную цепочку: повышение температуры — рост кинетической энергии — увеличение столкновений — денатурация при превышении порога. Не забудьте указать конкретный диапазон значений. В задачах на метаболизм мозг спасает тезисный план: путь, фермент, продукт, энергия. При объяснении регуляции вставляйте слова «аллостерический центр» и «обратимая ингибиция». Экзаменатор видит точные термины, ставит полный балл.
Мини-план повторения перед экзаменом и полезные ресурсы
Шаг первый: выпишите все термины и принципы на карточки. Шаг второй: прорешайте минимум двадцать задач из открытого банка. Шаг третий: соберите три лабораторных опыта дома — крахмал с амилазой, желатин с пепсином, перекись водорода с каталазой. Наблюдения закрепят теорию. Шаг четвёртый: проведите один пробный тест на время, соблюдая лимит 3 часа 55 минут. Шаг пятый: разберите ошибки, вернитесь к карточкам. Помните, одна попытка тренировки иногда ценнее часа чтения. Записаться на интенсивный онлайн курс подготовки к ЕГЭ можно на платформе el-ed.ru. Пять шагов, инструкция под рукой, — и раздел «Ферменты» больше не пугает, а приносит уверенные баллы.